کریسپر یک تکنولوژی چندمنظوره برای ویرایش ژنوم است که فناوری زیست پزشکی را به شیوه ای بی سابقه ترویج و ارتقا داده است. انتخاب ناقلهای مناسب برای هدف گیری ژن ها یک گام حیاتی در موفقیت آزمایشهای ویرایش ژنوم است. بنابراین، دانشمندان باید با توجه به هدف آزمایش، مناسب ترین ناقل را انتخاب کنند.
مطالعات in vitro یا in vivo
یکی از مواردی که باید در انتخاب ناقل مدنظر قرار داد؛ کاربرد آن برای استفاده در شرایط in vivo (یعنی به عنوان یک ناقل ژن درمانی) یا In vitro است. به عنوان مثال، یک ناقل انتخابی in vivo باید حداقل پاسخ ایمنی، پایداری بیشتر، و توانایی هدف قرار دادن بافت یا نوع سلول خاص را با دقت بیشتری داشته باشد.
اندازه ژن هدف
ناقل های ویروسی یا غیر ویروسی در اندازه انتقال ماده ژنتیکی با هم متفاوتند. به عنوان مثال قابلیت حمل قطعه ژنی یک ناقل AAV معمولا کمتر از ناقلهای آدنوویروسی است. ناقل های غیر ویروسی نیز می توانند قطعات ژنی بزرگتری را حمل کنند.
بیان پایدار یا موقت
برخی از وکتورها بیان ترانسژن طولانی مدت پایداری را ارائه می دهند، در حالی که برخی دیگر فقط در کوتاه مدت بیان می شوند. بسیاری از ناقل های ویروسی نیز با توانایی ادغام در ژنوم میزبان می توانند منجر به بیان ژن دائمی در سلول های هدف شوند.
از سوی دیگر بسته به کاربرد و هدف، ناقلین ویرایش ژنی با یکدیگر متفاوتند.
پلاسیمدهای مرتبط با کریسپر بسته به عملکرد آنها، در چندین مجموعه طبقه بندی میشوند که در بخش ذیل به آنها اشاره شده است:
-
مهندسی ژنوم
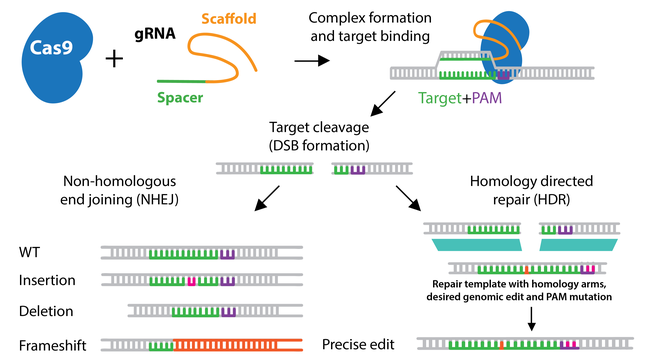
Cut: در سیستم CRISPR/Cas نوکلئاز Cas9 یک شکست دو رشته ای (DSB) را در یک مکان خاص بر اساس یک توالی هدف تعریف شده توسط gRNA ایجاد می کنند. DSB ها ترجیحاً در سلول توسط اتصال انتهایی غیر همولوگ (NHEJ) ترمیم می شوند، مکانیزمی که اغلب باعث درج یا حذف (indels) در DNA می شود. ایندل ها اغلب منجر به تغییر چارچوب خوانش می شوند و نهایتا جهش های از دست دادن عملکرد ایجاد می کنند. برای ایجاد تغییرات ژنومی خاص، محققان از الگوهای ترمیم ssDNA یا dsDNA استفاده میکنند. هنگامی که یک الگوی تعمیر وجود دارد، سلول ممکن است به جای NHEJ، یک DSB را با استفاده از تعمیر با واسطه همولوژی (HDR) تعمیر کند. در اکثر سیستمهای آزمایشی، HDR با راندمان بسیار پایینتری نسبت به NHEJ رخ میدهد.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | plasmid |
| Cas9, Puromycin resistance | lentiCRISPR v2 |
| hSpCas9-2A-Puro V2.0 | pSpCas9(BB)-2A-Puro (PX459) V2.0 |
| hSpCas9 | pSpCas9(BB)-2A-GFP (PX458) |
| Cas9, Blasticidin resistance | lentiCas9-Blast |
| SpCas9-NG | pX330-SpCas9-NG |
| GFP | LentiCRISPRv2GFP |
| humanized S. pyogenes Cas9 | pX330-U6-Chimeric_BB-CBh-hSpCas9 |
| Cas9, mCherry | LentiCRISPRv2-mCherry |
| Cas9-2A-eGFP | TLCV2 |
| Cas9 | DD-Cas9 with filler sequence and Venus (EDCPV) |
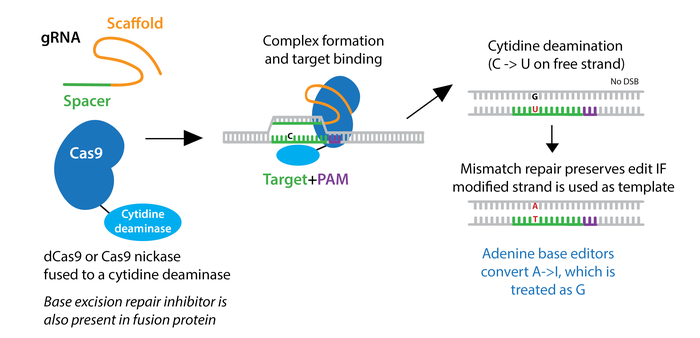
Base Edit: دو دسته از ویرایشگرهای باز – ویرایشگرهای باز سیتوزین (CBE) و ویرایشگرهای باز آدنین (ABE) – می توانند برای ایجاد ویرایش های جفت باز منفرد بدون شکست های دو رشته ای استفاده شوند. این پلاسمیدها برای القاء جهشهای تک نوکلئوتیدی C>T و A>G بصورت هدفدار مورد استفاده قرار می گیرند.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | plasmid |
| ecTadA(8e)-nSpCas9 (NG) | NG-ABE8e |
| BE4max | pCMV_BE4max |
| human codon optimized CBE4max SpCas9 variant named SpRY with P2A-EGFP | pCAG-CBE4max-SpRY-P2A-EGFP (RTW5133) |
| human codon optimized ABEmax(7.10) SpCas9 variant named SpRY with P2A-EGFP | pCMV-T7-ABEmax(7.10)-SpRY-P2A-EGFP (RTW5025) |
| ABEmax | pCMV_ABEmax |
| MMLVgag-3xNES-ABE8e | pCMV-MMLVgag-3xNES-ABE8e |
| ecTadA(8e)-nSpCas9 | ABE8e |
| ABEmax_P2A_GFP | pCMV_ABEmax_P2A_GFP |
| ecTadA(8e V106W)-nSpCas9 | ABE8e(TadA-8e V106W) |
| BE4max_P2A_GFP | pCMV_BE4max_P2A_GFP |
Nick: آنزیم های جهش یافته CRISPR/Cas نیکاز به جای شکستگیهای دو رشتهای ایجاد شده توسط آنزیمهای Cas نوع وحشی، شکافهای تکرشتهای با هدف gRNA را در DNA ایجاد میکنند. برای استفاده از جهشیافته نیکاز، به دو gRNA نیاز دارید که رشته های سنس و آنتی سنس DNA شما را در مجاورت یکدیگر مورد هدف قرار دهند. این شکافهای دوتایی یک شکست دو رشته ای (DSB) ایجاد می کنند که با استفاده از اتصال انتهایی غیر همولوگ مستعد خطا (NHEJ) تعمیر می شود. این استراتژی اثرات ناخواسته خارج از هدف (off-Target) را کاهش میدهند. جهشیافتههای نیکاز همچنین میتوانند با یک الگوی تعمیر برای اعمال ویرایشهای خاص از طریق تعمیر مبتنی بر همسانی (HDR) استفاده شوند.
از مهمترین پلاسمیدهای این قسمت:
| Gene/insert | plasmid |
| hSpCas9n | pSpCas9n(BB)-2A-GFP (PX461) |
| Cas9_D10A | hCas9_D10A |
| Cas9D10A-2A-GFP | pCas9D10A_GFP |
| humanized S. pyogenes Cas9 (D10A) nickase | pX335-U6-Chimeric_BB-CBh-hSpCas9n(D10A) |
| hSpCas9n | pSpCas9n(BB) (PX460) |
| AIO-GFP | |
| hSpCas9n-2A-Puro | pSpCas9n(BB)-2A-Puro (PX462) V2.0 |
| Cas9, Blasticidin resistance | lentiCas9n(D10A)-Blast |
| AIO-mCherry | |
| AIO-Puro |
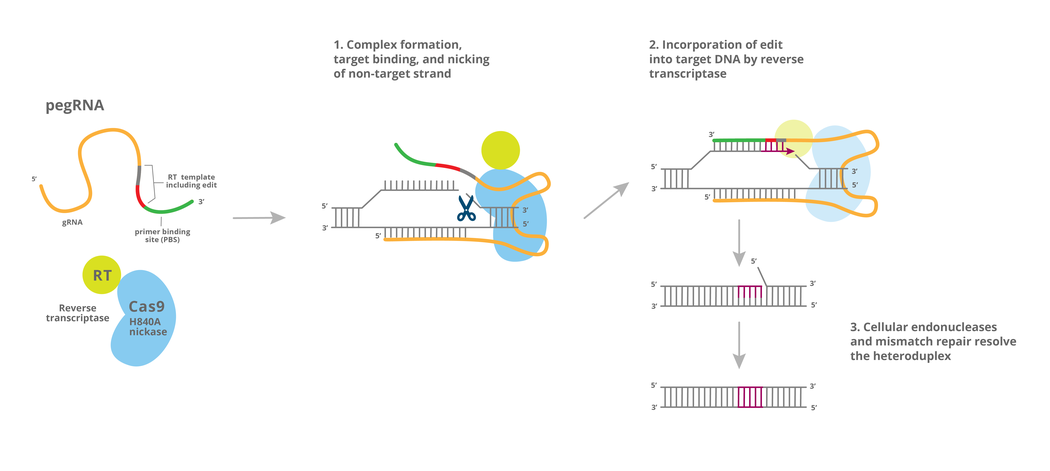
Prime Editing: این سیستم یک روش ویرایش ژن «جستجو و جایگزینی» است که در آن رونوشت بردار معکوس ویروس لوسمی موشی (M-MLV RT) به انتهای پروتئین نیکاز Cas9 ادغام میشود. آنزیم فیوژن با استفاده از یک RNA راهنمای ویرایش اولیه (pegRNA) قادر به ایجاد درجها، حذفها و تمامی تبدیلهای باز به باز ممکن است. همانند یک gRNA معمولی، pegRNA نیکاز را از طریق همولوژی با توالی DNA ژنومی به محل هدف هدایت می کند. pegRNA طولانیتر همچنین یک محل اتصال پرایمر (PBS) و ویرایشهای مورد نظر در قالب RT را کد میکند.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | plasmid |
| PEmax-P2A-EGFP | pCMV-PEmax-P2A-GFP |
| PEmax-P2A-BSD | pCMV-PEmax-P2A-BSD |
| PEmax-P2A-hMLH1dn | pCMV-PEmax-P2A-hMLH1dn |
| PEmax | pCMV-PEmax |
| PE2-P2A-GFP | pCMV-PE2-P2A-GFP |
| pCMV-SpCas9-XTEN3-RT(L139P)-(GGS)6-BxbINT | pDY1052 PASTEv3 pCMV-SpCas9-XTEN3-RT(L139P)-(GGS)6-BxbINT |
| PEmax | pT7-PEmax for IVT |
| PE2 | pCMV-PE2 |
| pCMV-SpCas9-XTEN-RT(L139P)-(GGGS)3-BceINT | pDY0863 PASTEv4 pCMV-SpCas9-XTEN-RT(L139P)-(GGGS)3-BceINT |
| PE1 | pCMV-PE1 |
-
تنظیم رونویسی
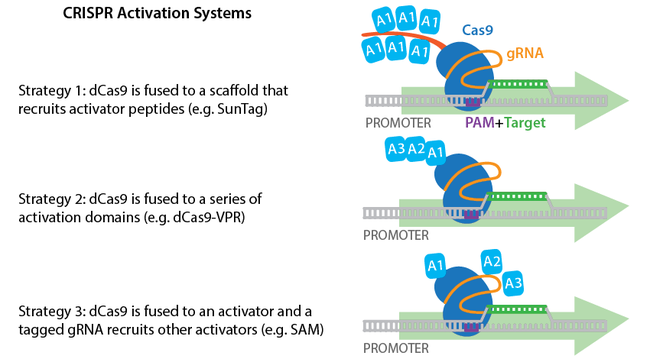
Activation: dCas9 غیرفعال که با یک پپتید فعال کننده رونویسی ترکیب شده است می تواند رونویسی یک ژن خاص را افزایش دهد. توالی gRNA خود را طوری طراحی کنید که فعال کننده dCas9 را به سمت پروموتر یا نواحی تنظیم کننده ژن مورد نظرتان هدایت کند.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | plasmid |
| dCas9 | pXPR_120 |
| dCAS9(D10A,H840A)-VP64_2A_GFP | dCAS9-VP64_GFP |
| dCas9-VPR | PB-TRE-dCas9-VPR |
| lentiSAMv2 | |
| SP-dCas9-VPR | SP-dCas9-VPR |
| dCAS9(D10A, N863A)-VP64_2A_Blast | lenti dCAS-VP64_Blast |
| dCas9 | pHRdSV40-NLS-dCas9-24xGCN4_v4-NLS-P2A-BFP-dWPRE |
| lenti-EF1a-dCas9-VPR-Puro | (Sp)dCas9-VPR-P2A-Puro |
| dCas9-VPR_P2A_mCherry | sp-dCas9-VPR_P2A_mCherry |
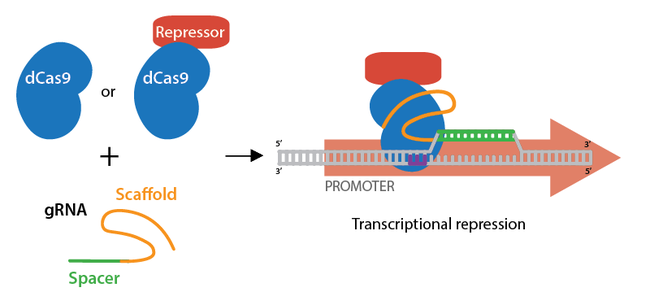
Interference: dCas9 ادغام شده به یک پپتید سرکوبگر رونویسی مانند KRAB، می تواند بیان ژن را با تداخل در رونویسی از بین ببرد. gRNA خود را طوری طراحی کنید که پروموتر/تقویت کننده ژن مورد نظرتان یا ابتدای توالی کدگذاری را هدف قرار دهد.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | plasmid |
| dCas9-KRAB-MeCP2 | dCas9-KRAB-MeCP2 |
| Cas9m4-KRAB-MeCP2 | pLX-TRE-dCas9-KRAB-MeCP2-BSD |
| dCas9-KRAB-P2A-mCherry, rtTA | pAAVS1-NDi-CRISPRi (Gen1) |
| KRAB-dCas9-P2A-mCherry fusion | pHR-SFFV-KRAB-dCas9-P2A-mCherry |
| humanized dCas9-KRAB T2A GFP, sgRNA | pLV hU6-sgRNA hUbC-dCas9-KRAB-T2a-GFP |
| dCas9-KRAB | dCas9-KRAB |
| ZIM3 (ZIM3 Synthetic) | pLX303-ZIM3-KRAB-dCas9 |
| dCas9-BFP-KRAB fusion | pHR-SFFV-dCas9-BFP-KRAB |
| dCas9-KRAB-MeCP2 | lenti_dCas9-KRAB-MeCP2 |
| dCas9 | pLX_311-KRAB-dCas9 |
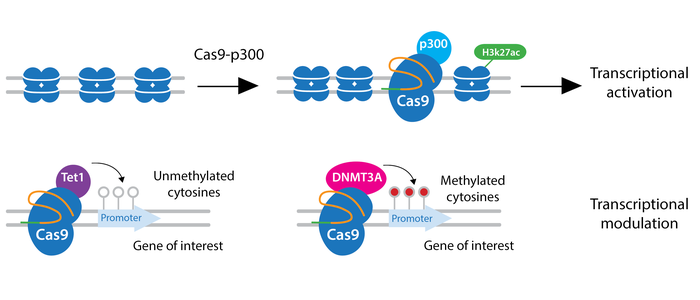
Epigenetics: برای ایجاد تغییرات اپی ژنتیکی هدفمند، محققان dCas9 غیرفعال را با اصلاحکنندههای اپی ژنتیک ترکیب کردهاند. gRNA خود را طوری طراحی کنید که یک پروموتر یا تقویت کننده خاص برای ژن مورد نظر شما را هدف قرار دهد.
تغییرات قابل انجام توسط این سیستم عبارتند از:
استیلاسیون هیستون توسط p300
دی متیلاسیون هیستون توسط LSD1
متیلاسیون سیتوزین توسط DNMT3A یا MQ1
دی متیلاسیون سیتوزین توسط Tet1
این تغییرات در طول زمان باقی می مانند و به طور بالقوه در سلول های در حال تقسیم قابل ارث هستند.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | Plasmid |
| S. pyogenes dCas9 fused with the catalytic domain of human DNMT3A (amino acids P602-V912) and T2A-EGFP (DNMT3A Human, Synthetic, S. pyogenes) | pdCas9-DNMT3A-EGFP |
| S.pyogenes dCas9 with c-terminal human p300 Core effector fusion (aa 1048-1664 of human p300) (EP300 Human, Synthetic, S. pyogenes) | pcDNA-dCas9-p300 Core |
| TETv4 (TET1CD-XTEN80-dCas9) | TETv4 |
| CRISPRoff-v2.1 (DNMT3A-DNMT3L-dCas9-BFP-KRAB) | CRISPRoff-v2.1 |
| dCas9-5xPlat2AflD-P2A-scFvGCN4sfGFPTET1CD | pPlatTET-gRNA2 |
| S.pyogenes dCas9 with c-terminal human p300 Core effector fusion (aa 1048-1664 of human p300) (EP300 Human, Synthetic, S. pyogenes) | pcDNA-dCas9-p300 Core (D1399Y) |
| S.pyogenes dCas9 with c-terminal human p300 Core effector fusion (aa 1048-1664 of human p300) (EP300 Human, Synthetic, S. pyogenes), pac from Streptomyces alboniger | pLV-dCas9-p300-P2A-PuroR |
| dCas9-Dnmt3a (DNMT3A Human, Synthetic) | Fuw-dCas9-Dnmt3a |
| scFvGCN4sfGFPTET1CD | pCAG-scFvGCN4sfGFPTET1CD |
| dCAS9-HDAC3 (HDAC3 Human, Synthetic, S. pyogenes) | dCas9-hHDAC3 |
-
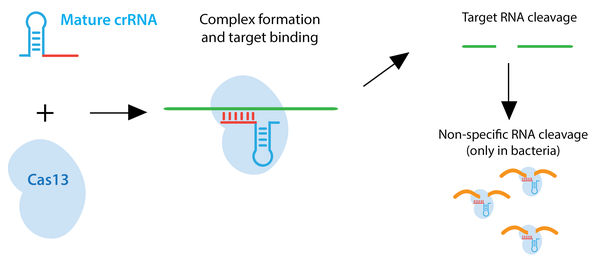
هدف گیری RNA
RNA Targeting: سیستم های کریسپر نوع VI، از جمله آنزیم های Cas13a/C2c2 و Cas13b، RNA را به جای DNA هدف قرار می دهند. این آنزیم ها در باکتریها، هنگامی که توالی RNA هدف را شناسایی کرده و برش دادند؛ یک حالت فعال آنزیمی اتخاذ میکنند و میتوانند RNAهای اضافی را بدون توجه به همولوژی با crRNA برش دهند.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | plasmid |
| PspCas13b | pC0046-EF1a-PspCas13b-NES-HIV |
| dCasRx | pXR002: EF1a-dCasRx-2A-EGFP |
| CasRx | pXR001: EF1a-CasRx-2A-EGFP |
| CasRx | pLentiRNACRISPR_005 – hU6-DR_BsmBI-EFS-RfxCas13d-NLS-2A-Puro-WPRE |
| pCMV – huDisCas7-11 mammalian expression | pDF0159 pCMV – huDisCas7-11 mammalian expression |
| dLwCas13a-msfGFP | pC035 – dLwCas13a-msfGFP |
| dPspCas13b | pHAGE-IRES-puro-NLS-dPspCas13b-3xEGFP-NLS-3xFlag |
| CasRx | pLentiRNACRISPR_007 – TetO-NLS-RfxCas13d-NLS-WPRE-EFS-rtTA3-2A-Blast |
| TetON-APEX2-V5-BPNLS-dRfxCas13d-dsRBD-BPNLS-P2A-GFP | dCas13d-dsRBD-APEX2 |
| LwCas13a-msfGFP | pC034 – LwCas13a-msfGFP-2A-Blast |
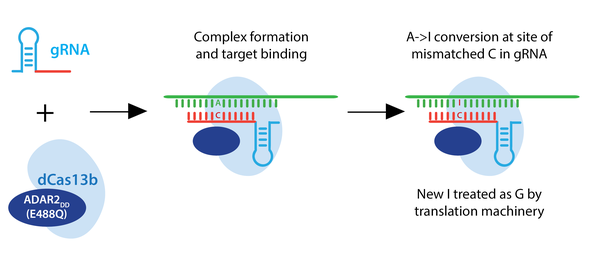
RNA Editing: سیستم های کریسپر نوع VI، از جمله آنزیم های Cas13a/C2c2 و Cas13b، RNA را به جای DNA هدف قرار می دهند. ادغام دمین کاتالیزوری آدنوزین دآمیناز ADAR2 (E488Q) به Cas13b غیرفعال، یک ویرایشگر RNA قابل برنامه ریزی ایجاد می کند که آدنوزین را به اینوزین در RNA تبدیل می کند. از آنجایی که اینوزین از نظر عملکردی معادل گوانوزین است، نتیجه یک تغییر A->G در RNA است. این سیستم قابلیت اصلاح جهشهای ژنتیکی بدون دستکاری ژنوم و خطرات مربوطه را فراهم می کنند. علاوه بر این مدلهای جهش یافته این سیستم به راحتی در داخل ذرات AAV قابل بسته بندی هستند.
از مهمترین پلاسمیدهای پستانداران این قسمت:
| Gene/insert | plasmid |
| PspCas13b, huADAR2DD (ADARB1 Human) | pC0054-CMV-dPspCas13b-longlinker-ADAR2DD(E488Q/T375G) |
| PspCas13b, huADAR2DD (ADARB1 Human) | pC0055-CMV-dPspCas13b-GS-ADAR2DD(E488Q/T375G)-delta-984-1090 |
| PspCas13b, huADAR2DD (ADARB1 Human) | pC0050-CMV-dPspCas13b-longlinker-ADAR2DD(wt) |
| PspCas13b, huADAR2DD (ADARB1 Human) | pC0050-CMV-dPspCas13b-longlinker-ADAR2DD(wt) |
| PspCas13b, huADAR2DD (ADARB1 Human) | pC0039-CMV-dPspCas13b-GS-ADAR2DD(E488Q) |
| dRanCas13b-ADAR2dd (RESCUE) | pC0078 RESCUE |
| PspCas13b, huADAR2DD (ADARB1 Human) | pC0048-CMV-dPspCas13b-longlinker-ADAR2DD(E488Q) |
| humanized minidCas13X.1-REPAIRv2 | U6-BbsI-DR_CMV-minidCas13X.1-REPAIRv2-BGHpA_CMV-EGFP-BGHpA |
| PspCas13b, huADAR1DD (ADAR Human) | pC0047-CMV-dPspCas13b-ADAR1DD(E1008Q) |
| PspCas13b, huADAR2DD (ADARB1 Human) | pC0053-CMV-dPspCas13b-GS-ADAR2DD(E488Q)-delta-984-1090 |
پلتفرم CRISPR/Cas9 شرکت پارس سیمرغ دارو دماوند با سالها تجربه در زمینه ویرایش ژن، متعهد به ارائه محصولات و خدمات حرفه ای و کارآمد به مشتریان با استفاده از سیستم CRISPR است.
نقش پلاسمیدهای CRISPR Cas9 در ویرایش ژن
پلاسمیدها، مولکولهای کوچک DNA حلقوی موجود در باکتریها، مدتهاست که توسط دانشمندان برای کاربردهای مختلف بیوتکنولوژی . مهندسی ژنتیک مورد استفاده قرار گرفته اند. نقش آنها در فناوری انقلابی ویرایش ژن CRISPR-Cas9 نیز از این قاعده مستثنی نیست. در حالی که بسیاری با ساختار و عملکرد اصلی پلاسمیدها آشنا هستند، اهمیت آنها در سیستم CRISPR-Cas9 موضوعی بسیار مورد توجه و پر اهمیت است.
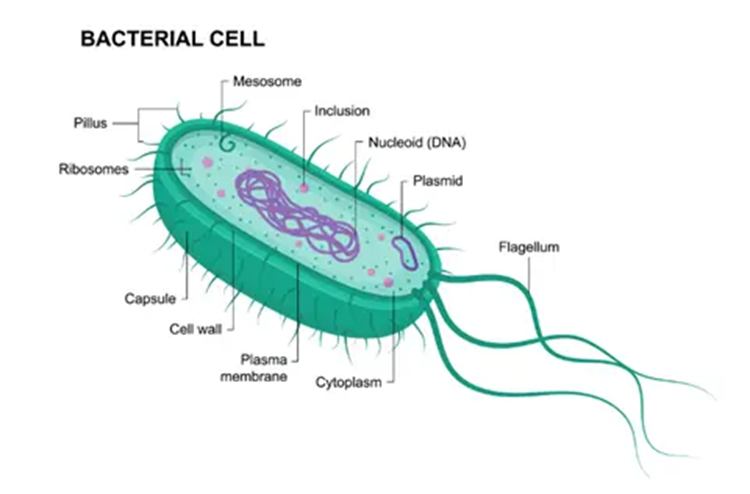
شکل 1-1: آناتومی یک سلول باکتریایی که ساختار آن را نشان میدهد، جایی که پلاسمیدها – مولکولهای کوچک و حلقوی DNA – مستقر بوده و تکثیر میشوند. این محیط پروکاریوتی برای تولید DNA پلاسمید اساسی است و سنگ بنای زیست شناسی مولکولی و تحقیقات ژنتیکی به شمار میرود.
-
اهمیت پلاسمیدهای CRISPR
مکانیسم دلیوری: پلاسمیدها به عنوان یک حامل برای وارد کردن اجزای CRISPR-Cas9 به سلول های هدف عمل می کنند. آنها اطلاعات ژنتیکی لازم، از جمله توالی کد کننده پروتئین Cas9 و توالی RNA راهنما را حمل می کنند و اطمینان حاصل می کنند که دستگاه ویرایش ژن به مقصد مورد نظر خود می رسد.
کنترل بیان: پلاسمیدها را می توان طوری مهندسی کرد که پروموتورهای خاصی داشته باشند. این موضوع به محققان اجازه می دهد بیان پروتئین Cas9 و RNA راهنما را کنترل کنند. استفاده از این پروموترها تضمین می کند که سیستم CRISPR فقط در شرایط خواسته شده و قابل کنترل فعال است و اثرات خارج از هدف را کاهش می دهد.
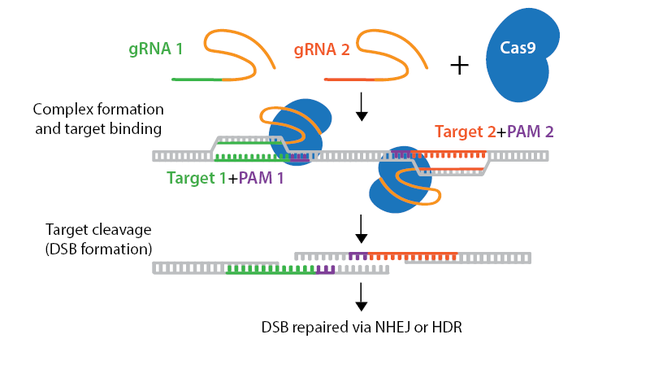
هدف گیری چندگانه: برخی از پلاسمیدهای پیشرفته می توانند چندین RNA راهنما را حمل کنند که امکان ویرایش همزمان چندین ژن را فراهم می کند. این قابلیت چندگانه سازی برای کارهای پیچیده مهندسی ژنتیک بسیار مهم است.
-
چالشهای مرتبط با پلاسمیدهای CRISPR
پلاسمیدها در سیستم CRISPR-Cas9 نقش اساسی داشته اند، اما کاربرد آنها بدون چالش نیست. یکی از نگرانی های اولیه کارایی تحویل پلاسمید به سلول هدف است. انواع مختلف سلول تمایلات متفاوتی برای جذب DNA خارجی دارند که منجر به نتایج ویرایش متناقض می شود. این ناهماهنگی می تواند یک مانع مهم باشد، به خصوص زمانی که تغییرات ژنتیکی دقیق مورد نیاز است. با به کارگیری microbial colony picker و single-cell dispenser ، اطمینان حاصل می کنید که سلول هایی با جذب موفق پلاسمید به طور موثر ایزوله شده و برای مطالعه بیشتر انتخاب می شوند.
چالش دیگر محدودیت اندازه پلاسمیدها است. پلاسمید ها فقط می توانند مقدار محدودی از مواد ژنتیکی را حمل کنند. این محدودیت زمانی آشکار میشود که محققان قصد دارند توالیهای DNA بزرگتر یا اجزای متعدد CRISPR را انتقال دهند. گاهی اوقات نیاز به متعادل کردن اندازه پلاسمید با عملکرد آن می تواند کارایی سیستم کریسپر را با چالش روبرو کند. از این رو، microbial colony picker میتواند ارزشمند باشد و به محققان این امکان را میدهد تا کلنیهایی را انتخاب کنند که پلاسمیدهای بزرگتر یا اجزای متعدد CRISPR را با موفقیت دریافت کردهاند.
در نهایت، انتقال DNA خارجی همیشه با خطرات ذاتی همراه است. حتی با دقت CRISPR، پتانسیل تغییرات ژنتیکی ناخواسته وجود دارد. این اثرات خارج از هدف می تواند عواقب غیر قابل پیش بینی داشته باشد، به ویژه در کاربردهای درمانی که ایمنی بیمار در درجه اول اهمیت دارد. سیستمهای تصویربرداری سلولی و میکروپلیتخوانها ابزارهای ارزشمندی در مرحله تحقیقات اولیه هستند که به بهینهسازی سنجشهای ویرایش ژنی کمک میکنند. با تجسم ویرایش در زمان واقعی، محققان می توانند اطمینان حاصل کنند که تغییرات ژنتیکی مورد نظر بدون اثرات خارج از هدف ایجاد می شود و ایمنی و قابلیت اطمینان سیستم CRISPR را افزایش می دهد.
توجه به این نکته مهم است که در حالی که دستگاههای تصویربرداری سلولی و میکروپلیتخوانها میتوانند تأیید اولیه را ارائه دهند، روشهای توالییابی همچون Sanger، برای تأیید اثرات خارج از هدف ضروری هستند. این روشهای توالییابی، بینشهای دقیقی را در مورد توالیهای ATGC (اگر DNA) یا AUGC (در صورت پروتئین) ارائه میدهند، که دقت و ایمنی فرآیند ویرایش ژن را تضمین میکند، بهویژه زمانی که به سمت تحقیقات بالینی یا قابلیت کاربرد در بیمار حرکت میکنیم.
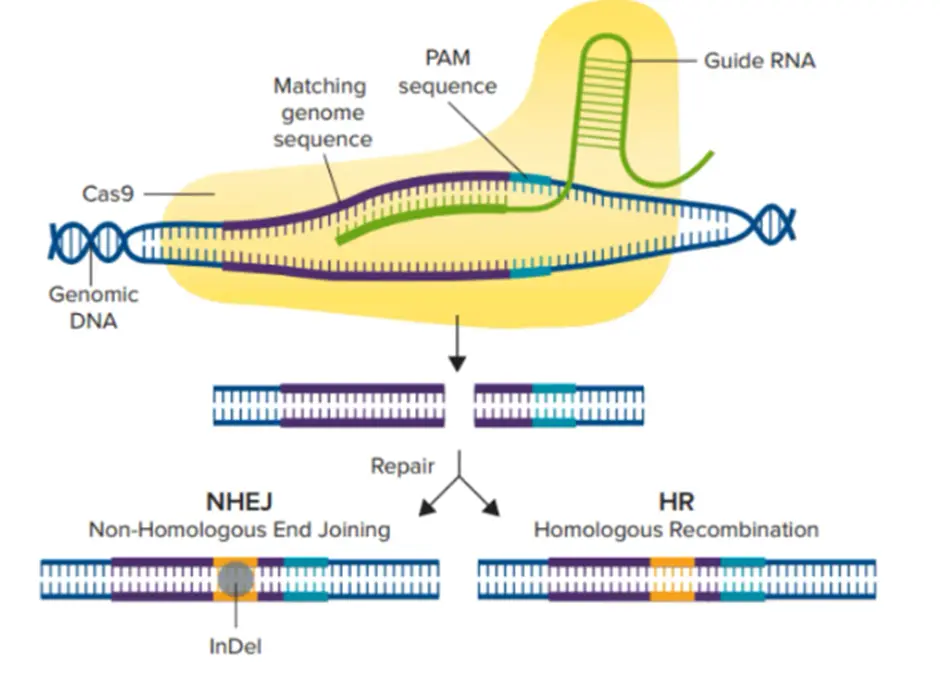
شکل 2-1: مکانیسم CRISPR/Cas9. آنزیم Cas9 با اتصال RNA راهنما به توالی ژنومی منطبق فعال شده و سپس 3 نوکلئوتید بالادست توالی PAM را برش میدهد. برش دو رشته ای ایجاد شده از طریق مسیر NHEJ یا HDR ترمیم شده و منجر به یک توالی ژن ویرایش شده می شود.
-
آینده پلاسمیدهای CRISPR
همانطور که ما در آستانه یک انقلاب ژنتیکی هستیم، نقش پلاسمیدها در فناوری کریسپر در حال تکامل است. چالش های امروزی راه را برای نوآوری های فردا هموار می کند. با تحقیقات در حال انجام، ما می توانیم توسعه پلاسمیدهای کارآمدتر را که به طور خاص برای سیستم CRISPR طراحی شده اند، پیش بینی کنیم. این پیشرفتها احتمالاً محدودیتهای فعلی را کاهش میدهند و کنترل و دقت بیشتری در ویرایش ژن ارائه میدهند.
علاوه بر این، با گسترش حوزه زیستشناسی سنتتیک، ممکن است مولکولهای سنتتیک را ببینیم که میتوانند مکمل یا حتی جایگزین پلاسمیدها در کاربردهای خاص باشند. این مولکولها سطح جدیدی از دقت و کنترل را ارائه خواهند کرد و سیستم CRISPR را بیش از پیش اصلاح میکنند.
در نتیجه، در حالی که پلاسمیدها در ظهور فناوری CRISPR اساسی بوده اند، نقش آنها در حال تکامل است. با تلاشهای ترکیبی محققان و رهبران صنعتی ، آینده ویرایش ژن روشن است و پیشرفتهای بیسابقهای در پزشکی، کشاورزی و فراتر از آن را نوید میدهد.






وقت بخیر مطلب بسیار جامعی بود، ایا میشه از این تکنیک برای درمان بیماریهایی که مرتبط با بافت CNS هست هم استفاده کرد؟ باتوجه به وجود BBB.